
Der Fokus meines Labors liegt auf den molekularen Mechanismen, die bei der Pathogenese und Entwicklung verschiedener Phänotypen der humanen diabetischen Retinopathie eine wichtige Rolle spielen. Durch die Kombination von Ganz-Exom-Sequenzierungsstudien und gut harmonisierten phänotypischen Analysen von Patienten und geeigneten Kontrollen untersuchen wir eine komplexe Krankheit wie die diabetische Retinopathie. Unter Verwendung von Zellkulturen und Tiermodellen planen wir, Genregulationswege und -netzwerke nach retinalen Zelltypen, vaskulär und nicht-vaskulär, zu entwickeln, die zu neuen therapeutischen Strategien zur Behandlung der diabetischen Retinopathie führen werden. Unser Ziel ist es, neue genetische Varianten und Proteine zu identifizieren, um die genetischen Mechanismen der diabetischen Retinopathie zu verstehen und bei der Entwicklung neuer Biomarker, verbesserter Therapeutika und Präzisionsmedizin zu helfen.
Die Dauer des Diabetes ist der stärkste Prädiktor für das Fortschreiten der diabetischen Retinopathie (DR), jedoch entwickeln einige Diabetiker trotz einer langen Diabetesdauer keine oder eine sehr leichte DR. Ebenso entwickeln nicht alle Diabetiker den das Sehvermögen bedrohenden Phänotyp des diabetischen Makulaödems (DME) oder der proliferativen diabetischen Retinopathie (PDR). Auch das Ansprechen auf Anti-VEGF-Medikamente (vaskulärer endothelialer Wachstumsfaktor) bei DMÖ ist variabel, wobei nur 30-40 % der Patienten („gute Responder“) gut auf die Behandlung ansprechen. Die Variabilität des Phänotyps von DR und des Ansprechens auf die Anti-VEGF-Behandlung bei DME legt eine mögliche Rolle genetischer Faktoren nahe. Bisher waren genetische Studien – Kopplungsanalyse, Kandidatengen und genomweite Assoziation (GWAS) – und nicht-genetische Studien zu DR nur begrenzt erfolgreich. Mit einer klar definierten, klinisch unterstützten phänotypischen Strategie führen wir derzeit die DRGen-Studie durch, um die Rolle seltener genetischer Varianten bei der DR-Progression oder dem Schutz und der Anti-VEGF-Antwort bei DME besser zu verstehen. Unsere Mitarbeiter sind Harvards Joslin Diabetes Center und Albuquerques Indian Health Services (IHS). Wir verwenden das Whole Exome Sequencing (WES), um systematisch die gesamten kodierenden Regionen des menschlichen Genoms zu durchsuchen, um DR-Suszeptibilitätsgene und Varianten zu erkennen, die durch konventionelle GWAS- oder Kopplungsanalysen nicht identifiziert werden können.
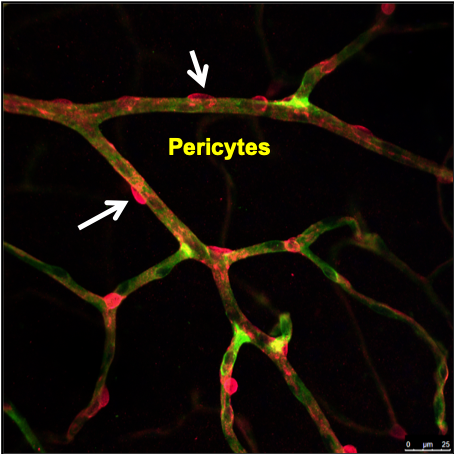
Eines der Kennzeichen der frühen diabetischen Retinopathie ist der Zusammenbruch der Blut-Netzhaut-Schranke, nämlich der Verlust von Perizyten in der menschlichen Netzhaut. Bei diabetischen Versuchstieren scheint der Perizyten-„Ausfall“ den neuartigen Mechanismus der Perizyten-Ablösung und -Migration zu beinhalten, der eine Vorstufe des Perizyten-Verlusts sein kann, der in der diabetischen Netzhaut beobachtet wird. Die „Perizytendysfunktion“ in den frühesten Stadien der diabetischen Retinopathie führt zu einer Veränderung der physikalischen Interaktion von Endothelzellen und Perizyten und der Fähigkeit der Perizyten, die endotheliale Permeabilitätsbarriere zu regulieren. Zusätzlich zu den definierten Rollen von PDGF, TGF-β und den Angiopoietinen bei der Unterstützung von Perizyten-Endothel-Interaktionen können weitere Faktoren eine wichtige Rolle spielen, die bei Erkrankungen der Netzhaut verändert werden könnten. Derzeit untersuchen wir das transkriptomische Profil von isolierten Perizyten und Endothelzellen von diabetischen Tieren. Unsere RNA-Transkriptom-Arbeit hat Einblicke in die Rolle relevanter Gene in Perizyten bei der Regulation der vaskulären Zellinteraktion und -funktion bei diabetischer Retinopathie gegeben. Diese Arbeit wird uns helfen, verbesserte therapeutische Strategien für Patienten mit sehbedrohendem diabetischen Makulaödem zu entwickeln.
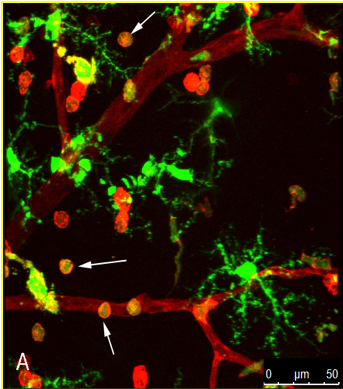
Unsere jüngste Arbeit untersuchte, wie Entzündungen eine sehr wichtige Rolle bei der Veränderung der Blut-Netzhaut-Schranke bei diabetischer Retinopathie spielen. Die Entzündungskaskade setzt mit dem Monozyten-Handel in die Netzhaut und der Mikroglia-Aktivierung bei Diabetes ein. Chemokine (wie CCl2, CCL5) sind wichtige Akteure in dieser Kaskade, da ihre Spiegel bei der frühen diabetischen Retinopathie deutlich erhöht sind. Durch die Verwendung von Knock-out-Mäusen und pharmakologischen Ansätzen haben wir die Strategie von Chemokin-Inhibitoren zur Verhinderung der erhöhten retinalen Gefäßleckage, wie sie bei Diabetes im Frühstadium beobachtet wird, etabliert. Wir entdeckten außerdem, dass Cathepsin D ein potentieller Mediator bei der erhöhten retinalen Endothelpermeabilität ist. Außerdem hat unser Team zum ersten Mal die Rolle von Angiopoietin-2 (Ang-2) bei der Veränderung des BRB und seiner Wechselwirkung mit Chemokinen hervorgehoben. Basierend auf unserer Forschungsarbeit laufen derzeit mehrere klinische Studien zum Ang-2-Signalweg bei Patienten mit diabetischem Makulaödem und Makuladegeneration.
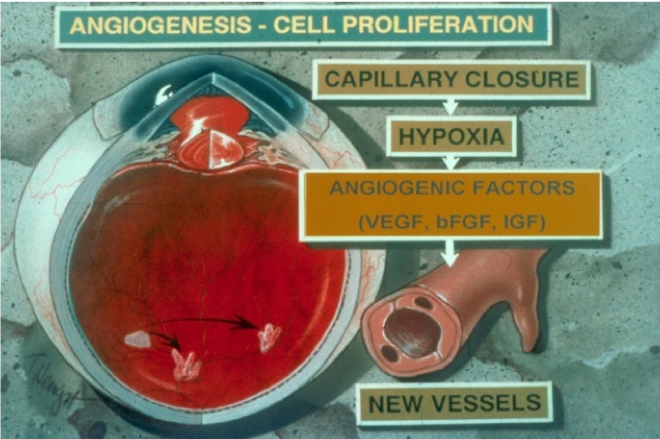
Meine frühere Arbeit befasste sich mit der Rolle von Proteinasen wie Matrix-Metalloproteinasen (MMPs) und Urokinase bei der retinalen und choroidalen Angiogenese. Wir haben zum ersten Mal die Rolle dieser Enzyme bei der Zellmigration während des Angiogeneseprozesses in der Netzhaut nachgewiesen. Wir fanden auch neue therapeutische Strategien unter Verwendung spezifischer Inhibitoren von MMPs und Urokinase, die die retinale Angiogenese in Tiermodellen erfolgreich unterdrücken könnten. Wir untersuchten weiter die Rolle der Proteinasen bei der Veränderung der Blut-Netzhaut-Schranke bei diabetischer Retinopathie. Diese Enzyme waren in den Netzhautgeweben bei Diabetes signifikant erhöht, wie in den Tiermodellen gezeigt. Unsere Arbeit hat erstmals gezeigt, dass diese Enzyme eine bedeutende Rolle beim Abbau der Zell-Zell-Verbindungen in Netzhautgefäßen bei Diabetes spielen. Diese Arbeit betonte die Entwicklung von Proteinase-Inhibitoren bei der Behandlung der retinalen Angiogenese und der Verhinderung einer erhöhten retinalen Gefäßpermeabilität und die Verwendung dieser Medikamente als potenzielle neue Klasse von Inhibitoren zusätzlich zu den herkömmlichen Anti-VEGF-Wirkstoffen bei diabetischer Retinopathie.
Als klinischer Prüfer war ich an der Teilnahme an klinischen Studien wie EDIC (Epidemiology of Diabetes Intervention and Complications), der Analyse ihrer Ergebnisse und dem Schreiben von Studienergebnissen als Mitglied des Schreibkomitees von EDIC beteiligt. Diese Arbeit hat nachdrücklich die Bedeutung einer strengen Blutzuckerkontrolle bei der Verlangsamung des Fortschreitens der diabetischen Retinopathie gezeigt. Eine intensive Insulintherapie reduziert das Langzeitrisiko einer Augenoperation bei Patienten mit Typ-1-Diabetes. Wir haben auch an vielen klinischen Studien mit pharmakologischen Ansätzen bei diabetischer Retinopathie teilgenommen (READ-2, RIDE/RISE, DRCR Protocol T, BOULEVARD, YOSEMITE).
Eine Studie zur Bewertung der Wirksamkeit und Sicherheit von Faricimab (RO6867461) bei Teilnehmern mit diabetischem Makulaödem
Ziel: Diese Studie untersucht die Wirksamkeit, Sicherheit und Pharmakokinetik von Faricimab, das nach Behandlungsbeginn in 8-wöchigen Intervallen oder wie im Protokoll angegeben verabreicht wird, im Vergleich zu Aflibercept alle 8 Wochen (Q8W) bei Teilnehmern mit diabetischem Makulaödem (DME).
Sponsor: Hoffmann-La Roche
Hauptforscher: Arup Das, MD, PhD
Klinischer Koordinator: Marija Zimkute
Langzeitwirkungen von Semaglutid auf die diabetische Retinopathie bei Patienten mit Typ-2-Diabetes.
Ziel: Ziel ist es, die Langzeitwirkungen einer Behandlung mit Semaglutid im Vergleich zu Placebo, die beide zur Standardbehandlung hinzugefügt wurden, auf die Entwicklung und das Fortschreiten einer diabetischen Retinopathie bei Patienten mit T2D zu bewerten.
Sponsor: Novo Nordisk
Ermittler: Arup Das, MD, PhD; Hauptprüfarzt: Mark Burge, MD
Klinischer Koordinator: Marija Zimkute
Erweiterungsstudie für das Port Delivery System mit Ranibizumab.
Ziel: In dieser Studie wird die langfristige Sicherheit und Verträglichkeit des Port Delivery Systems (PDS) mit 100 mg/ml Ranibizumab mit Nachfüllungen alle 24 Wochen (Q24W) für ca. 144 Wochen bei Teilnehmern mit neovaskulärer altersbedingter Makuladegeneration (nAMD) bewertet. die entweder die Phase-II-Studie GX28228 oder die Phase-III-Studie GR40548 abgeschlossen haben.
Sponsor: Hoffmann-La Roche
Hauptprüfer: Bryan Winkel, MD
Klinischer Koordinator: Marija Zimkute
Studie zu den Ergebnissen des Diabetes-Präventionsprogramms
Ziel: Eine multizentrische klinische Studie, die die Wirksamkeit einer intensiven Lebensstilintervention oder von Metformin untersucht, um die Entwicklung von Typ-2-Diabetes in einer Population zu verhindern oder zu verzögern, die aufgrund einer gestörten Glukosetoleranz als Hochrisikogruppe ausgewählt wurde.
Sponsor: National Institutes of Health (NIH)
Ermittler: Arup Das, MD, PhD; Hauptprüfarzt: David Schade, MD
Klinischer Koordinator: Janene Canady, RN
Epidemiologie von Diabetesinterventionen und Komplikationen
Ziel: Dies ist die nationale Langzeit-Follow-up-Studie derselben Gruppe, die in der Diabetes Control and Complications Trial (DCCT) untersucht wurde. Die Freiwilligen in dieser Studie haben Typ-1-Diabetes. EDIC folgt diesen Teilnehmern, um herauszufinden, ob eine Intensivtherapie das Risiko für Retinopathie, Nephropathie und Neuropathie verringert.
Sponsor: Nationale Gesundheitsinstitute (NIH); Nationales Institut für Diabetes und Verdauungs- und Nierenerkrankungen (NIDDK)
Hauptforscher: David Schade, MD
Ermittler: Arup Das, MD, PhD
Klinischer Koordinator: Janene Canady, RN