 Unsere Forschung konzentriert sich auf das Verständnis der molekularen Mechanismen, durch die Mutationen in Rhodopsin und in Genen, die seinen Handel regulieren, zu Netzhauterkrankungen führen. Rhodopsin ist ein Hauptbestandteil der lichtempfindlichen Membranen von Stäbchen-Photorezeptorzellen der Netzhaut, wo es als lichtempfindlicher GPCR fungiert, der die Phototransduktionskaskade initiiert. Rhodopsin ist auch ein zentraler Regulator der Gesundheit von Photorezeptoren und unterliegt über 150 verschiedenen Mutationen, die Retinitis pigmentosa verursachen. Mutationen, die den Rhodopsin-C-Terminus betreffen, verursachen schwere Formen der autosomal-dominanten Retinitis pigmentosa (ADRP). Im Rahmen unserer Forschung haben wir das Rhodopsin C-terminale VxPx-Motiv als konserviertes Ziliar-Targeting-Signal (CTS) definiert. Wir identifizierten die Bestandteile des Ziliar-Targeting-Komplexes, der dieses Signal erkennt, um den Rhodopsin-Transport und die Erneuerung der Photorezeptormembran der Netzhautstäbchen zu regulieren.
Unsere Forschung konzentriert sich auf das Verständnis der molekularen Mechanismen, durch die Mutationen in Rhodopsin und in Genen, die seinen Handel regulieren, zu Netzhauterkrankungen führen. Rhodopsin ist ein Hauptbestandteil der lichtempfindlichen Membranen von Stäbchen-Photorezeptorzellen der Netzhaut, wo es als lichtempfindlicher GPCR fungiert, der die Phototransduktionskaskade initiiert. Rhodopsin ist auch ein zentraler Regulator der Gesundheit von Photorezeptoren und unterliegt über 150 verschiedenen Mutationen, die Retinitis pigmentosa verursachen. Mutationen, die den Rhodopsin-C-Terminus betreffen, verursachen schwere Formen der autosomal-dominanten Retinitis pigmentosa (ADRP). Im Rahmen unserer Forschung haben wir das Rhodopsin C-terminale VxPx-Motiv als konserviertes Ziliar-Targeting-Signal (CTS) definiert. Wir identifizierten die Bestandteile des Ziliar-Targeting-Komplexes, der dieses Signal erkennt, um den Rhodopsin-Transport und die Erneuerung der Photorezeptormembran der Netzhautstäbchen zu regulieren.
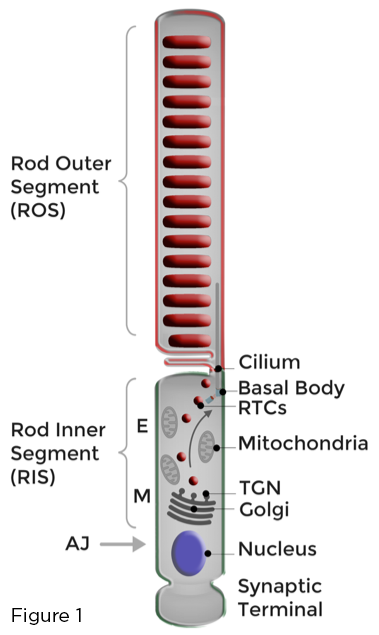 Die Grundlage für die optimale Funktion von Stäbchen-Photorezeptoren ist die strikte Kompartimentierung der Rhodopsin-beladenen lichtempfindlichen Membranen in das einzigartig modifizierte primäre Zilien, das das äußere Stäbchensegment (ROS) bildet. Die Homöostase der Stäbchen-Photorezeptoren wird durch die kontinuierliche Auffüllung lichtgeschädigter ROS-Membranen und die effiziente Sequestrierung von ROS-Proteinen und -Lipiden, die an der Phototransduktion beteiligt sind, aufrechterhalten, weg von denen, die an verschiedenen Zellfunktionen beteiligt sind, die im benachbarten Zellkörper, dem sogenannten inneren Stäbchensegment (RIS), stattfinden. oder am synaptischen Stäbchenterminal. Golgi und andere biosynthetische Organellen sind im RIS in der Myoidregion (M) lokalisiert. Der Transport von polarisierten Membranen in Netzhautstäbchen umfasst die Synthese, Sortierung und den Transport einer enormen Menge von Golgi-zu-Zilien-gerichteten Rhodopsin-Transportträgern (RTCs) durch das RIS. RTCs durchqueren die mit Mitochondrien gefüllte ellipsoide Region (E) und verschmelzen mit der RIS-Plasmamembran in der Nähe des Ziliens. Neu synthetisierte Membranen werden dann an das ROS geliefert (Abbildung 1).
Die Grundlage für die optimale Funktion von Stäbchen-Photorezeptoren ist die strikte Kompartimentierung der Rhodopsin-beladenen lichtempfindlichen Membranen in das einzigartig modifizierte primäre Zilien, das das äußere Stäbchensegment (ROS) bildet. Die Homöostase der Stäbchen-Photorezeptoren wird durch die kontinuierliche Auffüllung lichtgeschädigter ROS-Membranen und die effiziente Sequestrierung von ROS-Proteinen und -Lipiden, die an der Phototransduktion beteiligt sind, aufrechterhalten, weg von denen, die an verschiedenen Zellfunktionen beteiligt sind, die im benachbarten Zellkörper, dem sogenannten inneren Stäbchensegment (RIS), stattfinden. oder am synaptischen Stäbchenterminal. Golgi und andere biosynthetische Organellen sind im RIS in der Myoidregion (M) lokalisiert. Der Transport von polarisierten Membranen in Netzhautstäbchen umfasst die Synthese, Sortierung und den Transport einer enormen Menge von Golgi-zu-Zilien-gerichteten Rhodopsin-Transportträgern (RTCs) durch das RIS. RTCs durchqueren die mit Mitochondrien gefüllte ellipsoide Region (E) und verschmelzen mit der RIS-Plasmamembran in der Nähe des Ziliens. Neu synthetisierte Membranen werden dann an das ROS geliefert (Abbildung 1).
Die Sortierung in RTCs wird durch die kleinen GTPasen der Rab- und Arf-Familien reguliert, die eine zentrale Rolle bei der Organisation des intrazellulären Membrantransports sowie der Membranabgabe an primäre Zilien spielen. Proteine, die an der Bildung und Aufrechterhaltung von Zilien beteiligt sind, werden von etwa 25 % der ererbten Gene für Netzhauterkrankungen kodiert, wobei Mutationen Netzhautdegeneration, zystische Nieren, Fettleibigkeit und Neuralrohrdefekte bei einem breiten Spektrum genetischer Störungen verursachen, die zusammen als Ziliopathien bekannt sind.
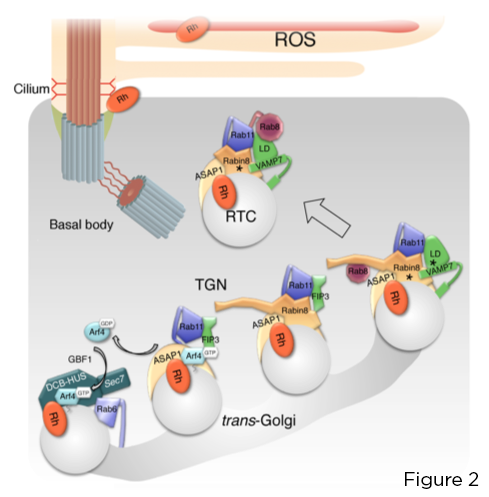 Die kleine GTPase Arf4 erkennt und bindet direkt das Rhodopsin C-terminale VxPx CTS. Arf4, aktiviert am Photorezeptor Golgi durch den Arf-Guanin-Nukleotid-Austauschfaktor (GEF) GBF1, initiiert einen schrittweisen Aufbau des Targeting-Nexus, der um das Arf-GTPase-aktivierende Protein (GAP) ASAP1 zentriert ist, das die GTP-Hydrolyse auf Arf4 und Rab11a . vermittelt -FIP3-Rabin8 Dual-Effektor-Komplex. Dieser Komplex steuert den Zusammenbau des hochkonservierten Rab11a-Rabin8-Rab8-Targeting-Moduls, das das R-SNARE-VAMP7 direkt auf RTCs rekrutiert, um deren Fusion an der Ziliarbasis zu regulieren, über die VAMP7-Paarung mit den verwandten Plasmamembranen SNAREs Syntaxin 3 und SNAP-25 (Figur 2).
Die kleine GTPase Arf4 erkennt und bindet direkt das Rhodopsin C-terminale VxPx CTS. Arf4, aktiviert am Photorezeptor Golgi durch den Arf-Guanin-Nukleotid-Austauschfaktor (GEF) GBF1, initiiert einen schrittweisen Aufbau des Targeting-Nexus, der um das Arf-GTPase-aktivierende Protein (GAP) ASAP1 zentriert ist, das die GTP-Hydrolyse auf Arf4 und Rab11a . vermittelt -FIP3-Rabin8 Dual-Effektor-Komplex. Dieser Komplex steuert den Zusammenbau des hochkonservierten Rab11a-Rabin8-Rab8-Targeting-Moduls, das das R-SNARE-VAMP7 direkt auf RTCs rekrutiert, um deren Fusion an der Ziliarbasis zu regulieren, über die VAMP7-Paarung mit den verwandten Plasmamembranen SNAREs Syntaxin 3 und SNAP-25 (Figur 2).
Im Zentrum der Rab11a-Rabin8-Rab8-Ziliarkaskade steht das Rab8 GEF Rabin8, ein multifunktionales Gerüstprotein, das mit ausgewählten Ziliarproteinen wie dem TRAPPII-Transportkomplex und dem BBSom interagiert, was auf eine zentrale Rolle in den Ziliarwegen sensorischer Rezeptoren hinweist. Seine Funktion wird durch Mutationen in der NDR2-Kinase (STK38L) beeinflusst, die durch das Gen für frühe retinale Degeneration (erd) des Hundes kodiert wird, das der humanen Ziliopathie Leber congenitaler Amaurose (LCA) entspricht. Unsere aktuelle Studie zeigt, dass humanes GFP-Rabin8 in transgenen X. laevis kolokalisiert mit endogenem Rabin8 und Rhodopsin am Golgi und auf RTCs und ebnet den Weg für zukünftige Studien zur Rolle von Rabin8 bei der Membranprogression entlang des Ziliarweges, der bei erblichen degenerativen Netzhauterkrankungen möglicherweise gestört ist.
Insgesamt zeigten unsere Studien, dass das Membran-Targeting auf ROS eine konservierte Form des Ziliar-Targetings ist. Das VxPx-Motiv ist in anderen Ziliarmembranproteinen vorhanden. Der konservierte Arf4-basierte Targeting-Komplex zielt auf sensorische Rezeptoren auf primäre Zilien durch komplizierte funktionelle Netzwerke kleiner GTPasen und deren Regulatoren ab, die äußerst empfindlich auf Mutationen reagieren, die Netzhautdegenerationen und Ziliopathien verursachen.
Deretic D., Lorentzen E. und Fresquez T. (2019). Die Besonderheiten des Arf4-basierten Ziliarmembran-Targeting-Komplexes. Kleine GTPasen. Kleine GTPas. 2019 Mai 9:1-12. doi: 10.1080/21541248.2019.1616355. [Epub vor Druck]
Kandachar V, Tam BM, Moritz OL und Deretic D. (2018)Ein Interaktionsnetzwerk zwischen SNARE VAMP7 und Rab-GTPasen innerhalb eines Ziliarmembran-Targeting-Komplexes. J Cell Sci. (2018) J Cell Sci. 2018 Dez 10;131(24). pii: jcs222034. doi: 10.1242/jcs.222034.
Wang J., Fresquez T. Kandachar V. und Deretic D. (2017). Die Arf GEF GBF1 und Arf4 wirken mit der sensorischen Rezeptorfracht Rhodopsin zusammen, um den Transport der Ziliarmembran zu regulieren. J Cell Sci. J Cell Sci. 2017 Dez 1;130(23):3975-3987. doi: 10.1242/jcs.205492. Epub 2017 Okt. 12.
Vetter M, Wang J, Lorentzen E und Deretic D. (2015)Neue Topographie des Rab11-Effektor-Interaktionsnetzwerks in einem Ziliarmembran-Targeting-Komplex. Kleine GTPas. 2015 Okt 2;6(4):165-73. doi: 10.1080/21541248.2015.1091539. Ausgabe vom 2015. September 23
Wang J und Deretic D. (2015)Der Arf- und Rab11-Effektor FIP3 wirkt synergistisch mit dem Arf GAP ASAP1, um Rabin8 beim Ziliarrezeptor-Targeting zu steuern. J Cell Sci. J Cell Sci jcs.162925; Advance Online-Artikel 11. Februar 2015, doi:10.1242/jcs.162925 (2015).
Wang J. und Deretic D. (2014). Molekulare Komplexe, die den Rhodopsin-Transport zu primären Zilien lenken. Prog Retin Eye Res. 2014 Jan; 38:1-19. doi: 10.1016/j.preteyeres.2013.08.004. Epub 2013 Okt 14
Wang J, Morita Y, Mazelova J und Deretic D. (2012). Die Arf GAP ASAP1 bietet eine Plattform zur Regulierung des Arf4- und Rab11-Rab8-vermittelten Ziliarrezeptors. EMBO J 31, 4057-4071.
Mazelova J, Ransom N, Astuto-Gribble L, Wilson MC und Deretic D. (2009) Syntaxin 3 und SNAP-25-Paarung, reguliert durch Omega-3-Docosahexaensäure (DHA), steuert die Zufuhr von Rhodopsin für die Biogenese von Zilien. abgeleitete Sinnesorganellen, die äußeren Stäbchensegmente. J. Cell Sci. 122, 2003-2013.
Mazelova J, Astuto-Gribble L, Inoue H, Tam BM, Schonteich E, Prekeris R, Moritz OL, Randazzo PA und Deretic D. (2009) Ciliary Targeting Motiv VxPx steuert die Montage eines Trafficking-Moduls durch Arf4. EMBO J. 28, 183-192.
Deretic D, Williams AH, Ransom N, Morel V, Hargrave PA und Arendt A. (2005)Rhodopsin C-Terminus, der Ort von Mutationen, die Netzhauterkrankungen verursachen, reguliert den Handel durch Bindung an ARF4. Proc. Natl. Acad. Sci. VEREINIGTE STAATEN VON AMERIKA. 102: 3301-3306.
Assoziierter Wissenschaftler
Theresa Fresquez
Telefon: (505) 272-6120
Email: TFresquez@salud.unm.edu