Hauptforscher:
Matthew Campen, PhD
Lehrer,
Pharmazeutische Hochschule
MCampen@salud.unm.edu
(505) 272-3329
Physische Adresse des Labors
Gebäude der Pflegeapotheke, Raum B-3
Postanschrift des Labors
Institut für Pharmazeutische Wissenschaften
MSC09
1 Universität von New Mexico
Albuquerque, NM 87131-0001

Top: Jessica Begay (MS-Studentin), Tamara Young (Doktorandin), Alexis Wilson (UPN-Studentin), Raul Salazar (Pharm.D.-Studentin), Katherine Zychowski, Ph.D. (Wissenschaftlicher Assistenzprofessor).
Unten: Matthew Campen, Ph.D. (Professor), Guy Herbert (Forschungsspezialist) Russell Hunter (Doktorand), Selita Lucas (Forschungsspezialist), Jesse Denson, Ph.D. (Wissenschaftlicher Kommunikationsdirektor), Thomas Wilson (Pharm.D.-Student), Barry Bleske, Pharm.D. (Lehrstuhl für Pharmazie und Verwaltungswissenschaften).
Dr. Campen leitet das Labor für kardiovaskuläre Toxikologie im Fachbereich Pharmazeutische Wissenschaften. Zusammen mit den Kollegen Barry Bleske, Pharm.D. und Katherine Zychowski, Ph.D., untersucht die Gruppe in erster Linie die kardiovaskulären Auswirkungen von Umweltgiften. Die aktuelle Forschung befasst sich mit dem Verständnis, wie inhalierte Giftstoffe, einschließlich Nanomaterialien, Partikel aus Uranminen und Ozon, die Blutgefäße im ganzen Körper negativ beeinflussen können.
Dr. Campen leitet das KL2 Mentored Career Development Program innerhalb des UNM Clinical and Translational Sciences Center. Er ist auch stellvertretender Direktor für die Bewertung der UNM-Metallexposition und -toxizität auf Stammesgebieten im Südwesten (UNM METALS) Superfund Research Program Center. Diese Programme betonen die Translation der Umweltgesundheits- und Toxikologieforschung vom Labor zum Krankenbett – oder vom Labor zum Graben, wie im Fall der Gemeinschaftsarbeit – und diese translationale Relevanz ist in einen Großteil des Ansatzes des kardiovaskulären Toxikologie-Labors integriert.
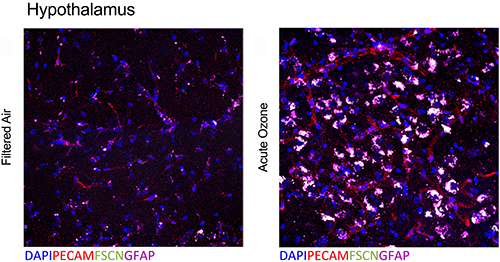
Überlappende Beeinträchtigung der Blut-Hirn-Schranke (BBB) und Astrozytenaktivierung an der neurovaskulären Einheit nach akuter O3-Exposition (Tyler et al., Toxicol Sci, 2019).
Luftverschmutzung, insbesondere Feinstaub (PM), hat einen erheblichen Einfluss auf die globale Gesundheit. Die Weltgesundheitsorganisation schätzt jährlich 800,000 zusätzliche kardiopulmonale Todesfälle durch Mechanismen, die nicht ganz klar sind. Laufende Arbeiten in unserem Programm haben potenzierende Wechselwirkungen zwischen PM aus der Verbrennungsquelle und assoziierten gasförmigen Komponenten gezeigt, die die systemische Gefäßtoxizität verstärken können. Trotz der Schutzbarriere durch die Lunge ist das systemische Gefäßendothel ein anfälliges Ziel von Luftverschmutzungstoxizität und empfindlich gegenüber den Kombinationen von Feinstaub und Gaskomponenten. Klassische Ergebnisse der inflammatorischen Endothelaktivierung sind bei Tieren und Menschen zu beobachten, die einer Vielzahl von Schadstoffen ausgesetzt sind; solche Reaktionen sind von zentraler Bedeutung für die frühe Entwicklung von Atherosklerose und auch für Ereignisse im Spätstadium, wie z. B. Plaque-Instabilität und Ruptur. Unklar bleibt, auf welchem Weg die Giftigkeit der Luftverschmutzung von der Lunge auf das Gefäßsystem übertragen wird. Wir postulieren, dass eine entzündliche endotheliale Aktivierung nach Inhalation von Luftschadstoffen durch oxidative Modifikationen von Blutbestandteilen auftritt und einen gemeinsamen Wirkmechanismus vieler Schadstoffe widerspiegelt. Plasma von Menschen, die Diesel oder Stickstoffdioxid ausgesetzt waren, aktiviert Endothelzellen, was darauf hindeutet, dass die Toxizität von der Lunge auf systemische Gefäße über den Blutkreislauf übertragen wird. Multiliganden-Scavenger- und Mustererkennungsrezeptoren auf Endothelzellen, einschließlich des Lechtin-ähnlichen Rezeptors für oxidiertes LDL (LOX-1) und CD36, können eine fokale Verbindung darstellen, die die komplexen Serumveränderungen auf häufige vaskuläre pathologische Reaktionen reduziert. Die Ziele des erneuerten Projekts bestehen darin, zwei Schlüsselergebnisse aus dem ursprünglichen Projekt zu erweitern: 1) Gase und Feinstaub wirken zusammen, um die Gefäßtoxizität zu erhöhen und 2) inhalierte Schadstoffe erhöhen das zirkulierende Entzündungspotential. Daher werden wir in Ziel 1 die Wechselwirkungen zwischen PM und flüchtigen organischen Stoffen bei der Förderung der systemischen Gefäßtoxizität aufklären. Hier stellen wir die Hypothese auf, dass die Kombination von PM mit dem gasförmigen Anteil der Kraftfahrzeugemissionen die vaskuläre Toxizität in Abhängigkeit von der Oberfläche und Zusammensetzung der PM erhöht. In Ziel 2 werden wir das zirkulierende Entzündungspotenzial in Bezug auf Komponenten der kombinierten Motoremissionen messen und die Ergebnisse mit neuartigen statistischen Methoden für komplexe Gemische analysieren. Wir gehen davon aus, dass die Wirksamkeit der akuten Endothelzellaktivierung durch zirkulierende Faktoren dosisabhängig ist, durch kombinierte PM- und Gasphasen verstärkt wird und mit chronischem Gefäßumbau und oxidativem Stress korreliert. Schließlich werden wir in Ziel 3 den relativen Beitrag von CD36 und LOX-1 bei der Förderung der pulmonalen Erzeugung von und der endothelialen Reaktion auf durch O3 und MVE induzierte zirkulierende Faktoren beschreiben. Wir stellen die Hypothese auf, dass trotz der komplexen atmosphärischen Chemie und der Serumzusammensetzung, die sich bei Umweltverschmutzung ändert, die Multiligandenrezeptoren CD36 und LOX-1 die endotheliale Reaktion und die NOS-Inaktivierung vermitteln.
(mit Dr. Andrew Ottens, unten):
Engineered Nanomaterialien (ENMs) haben ein unbekanntes toxisches Potenzial und die Beziehung zwischen den biologischen Wirkungen und den physikalisch-chemischen Eigenschaften bleibt ungewiss. Unser langfristiges Forschungsziel ist es, ein effizientes und genaues Sicherheitsprofil von ENM mit unterschiedlichen Eigenschaften und Expositionsbedingungen zu ermöglichen, das die Entscheidungsfindung in Bezug auf Expositionsrisiken beim Menschen verbessern würde. Unser Ziel in dieser Anwendung ist es, Veränderungen der Serumzusammensetzung zu bestimmen, die aus einer pulmonalen ENM-Exposition resultieren und zu systemischer Toxizität (vor allem vaskulär und neural) führen. Wir schlagen die folgenden spezifischen Ziele vor, die innovative Ex-vivo-Bioaktivitätsergebnisse mit fortschrittlicher hochauflösender Massenspektroskopie-Zusammensetzungsanalyse verbinden. Im ersten Ziel werden wir Mechanismen des pulmonalen Ursprungs von modifizierten Kreislaufkomponenten im Zusammenhang mit der Metalloproteinase-Aktivität und Entzündung ermitteln. Es gibt Hinweise darauf, dass zirkulierende Faktoren mit a) direkten Reaktionen von ENMs und pulmonalen zellulären/molekularen Komponenten oder b) Abbau-Nebenprodukten einer erhöhten Metalloproteinase-Aktivität zusammenhängen können und dass die zirkulierenden Komponenten durch Mustererkennungsrezeptoren der Endothelzelloberfläche wirken. Im zweiten Ziel werden wir die Auswirkungen von pulmonalen ENM-induzierten Serommodifikationen auf das neurovaskuläre und das zentrale Nervensystem bewerten. Hier werden wir einen Sequenz-Tag-basierten Algorithmus entwickeln und optimieren, um die Identifizierung endogener Peptide innerhalb des mehrwandigen Carbon-Nanotube-(MWCNT)-responsiven Seroms zu verbessern, der die Bewertung der ENM-induzierten Bioaktivierung im Zerebrovaskulatur und der Diffusionsfähigkeit erleichtern wird von ENM-responsiven Seromfaktoren über die Blut-Hirn-Schranke. Schließlich werden wir im dritten Ziel MWCNT-assoziierte Kreislaufeigenschaften und das Entzündungspotential in Proben einer beruflich exponierten Kohorte untersuchen. Wir werden die Serumbioaktivität in Bezug auf die Endothelaktivierung bewerten und mit persönlichen Atemzonenmessungen von elementarem Kohlenstoff, einem Marker für die Exposition gegenüber Kohlenstoffnanoröhren/Nanofasern, verknüpfen. Bei Abschluss dieses Projekts gehen wir davon aus, dass wir physiologische und chemische Schlüsselfaktoren identifiziert haben, die die Plasma-übertragene ENM-Toxizität beeinflussen. Der erfolgreiche Abschluss dieser Studien wird voraussichtlich einen wichtigen Schritt zur Vorbeugung/Abschwächung der mit der ENM-Exposition verbundenen Gesundheitsschäden darstellen.
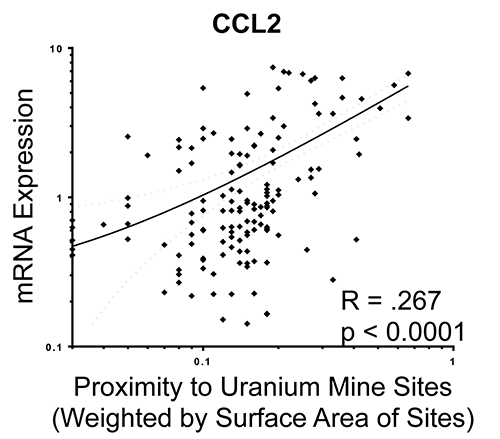
Lineares Regressionsdiagramm der gewichteten Näheassoziationen von verlassenen Uranminen mit Chemokin-Ligand-2-(CCL2)-mRNA aus Endothelzellreaktionen auf Teilnehmerserum (Harmon et al., JESEE, 2017).
Herz-Kreislauf- und Stoffwechselerkrankungen nehmen landesweit zu, und eine wachsende Zahl von Beweisen unterstreicht die Rolle von Umweltschadstoffen als begleitende Faktoren für Herz-Kreislauf-Erkrankungen (CVD). In New Mexico und der Navajo-Nation existieren viele verlassene und nicht sanierte Bergbauregionen und kontaminieren weiterhin Land, Wasser und Luft. Das Einatmen von metallreichen Feinstaub (PM) aus Bergbauabfällen kann in betroffenen Gemeinden ein unerkanntes Risiko für Herz-Kreislauf- und Lungenerkrankungen darstellen. Es besteht ein starker Zusammenhang zwischen Metallen in luftgetragenem PM und ungünstigen kardiovaskulären und pulmonalen Folgen, insbesondere chronischen entzündlichen Gefäßerkrankungen. Ein Großteil der Toxikologie konzentrierte sich jedoch auf lösliche Metallformen, die für die Verbrennung von Restöl in der Schifffahrtsindustrie relevanter sind. Es gibt zahlreiche Standorte im Südwesten der USA, an denen Bergbauabfälle zu einer schweren Bodenkontamination von Metallgemischen geführt haben, was zu hohen Gehalten an Uran (U), Kupfer (Cu), Vanadium (V), Nickel (Ni) und Arsen (As .) geführt hat ), unter anderen. Wir werden die direkten und indirekten atherogenen Auswirkungen von eingeatmetem Feinstaub aus Gemeinden mit einer Vorgeschichte von Mischmetallkontaminationen bewerten. Das Arbeitsmodell bezieht sich auf komplexe Interaktionen in der Lunge, die zu sekundären Kreislaufprodukten führen, die vaskuläre endotheliale Entzündungsreaktionen induzieren. Immunmodulatorische Rezeptoren wie CD36, TLR4 und der Lechtin-ähnliche Rezeptor für oxidiertes Lipoprotein niedriger Dichte (LOX-1) vermitteln vaskuläre Reaktionen auf andere feste und gasförmige Bestandteile der Luftverschmutzung. Der Einfluss von Metallen auf die vaskuläre angeborene Immunantwort ist kaum erforscht. Wir gehen davon aus, dass die Exposition der Lunge gegenüber metallreichen PM aus mit Minenabfällen kontaminierten Stammesregionen zirkulierende Faktoren wie oxidiertes LDL erzeugen wird, die wiederum entzündliche Reaktionen und Dysfunktionen in Endothelzellen aktivieren, abhängig von immunmodulatorischen Rezeptoren. Die folgenden Ziele werden dieser Hypothese auf mechanistische und translationale Weise nachgehen. Im ersten Ziel werden wir die Wirksamkeit von eingeatmeten Staubproben aus Bergbauregionen im Hinblick auf die systemische Gefäßtoxizität und das Serumentzündungspotenzial vergleichen. Im zweiten Ziel untersuchen wir die Rolle von oxLDL und immunmodulatorischen Rezeptoren bei der Förderung der endothelialen Aktivierung und Dysfunktion aufgrund der Exposition gegenüber metallreichen PM. Wir werden den oxLDL/LOX-1-Weg selektiv in vivo und in vitro antagonisieren, um die Ergebnisse von endothelialer Dysfunktion und vaskulärer Entzündung zu bewerten. Schließlich werden wir im dritten Ziel die Exposition in Windrichtung in einer Navajo-Kohorte modellieren, um Assoziationen mit zirkulierenden Markern für Endothelverletzungen und Serumentzündungspotential zu untersuchen. Wir werden die Exposition gegenüber vom Wind verwehten Staub modellieren und mit den Ergebnissen von Entzündungs-/Endothelverletzungsmarkern (oxLDL, lösliches ICAM und VCAM, Endothelin-1) und Serumbioaktivität von einer Kohorte von 252 Mitgliedern der Navajo-Nation verknüpfen.
Tyler CR, Zychowski KE, Sanchez BN, Rivero V, Lucas S, Herbert G, Liu J, Irshad H, McDonald JD, Bleske BE, Campen MJ. Die Oberflächenabhängigkeit der Gas-Partikel-Wechselwirkungen beeinflusst die pulmonalen und neuroinflammatorischen Ergebnisse. Teil Fiber Toxicol. 13:64, 2016. PMID: 27906023; PMC5131556
Zychowski KE, Sanchez B, Pedrosa RP, Lorenzi-Filho G, Dräger LF, Polotsky VY, Campen MJ. Serum von Patienten mit obstruktiver Schlafapnoe induziert Entzündungsreaktionen in Endothelzellen der Koronararterien. Atherosklerose. 254:59-66, 2016. PMID: 27693879; PMC5097675
Harmon ME, Lewis J, Miller C, Hoover J, Ali AS, Shuey C, Cajero M, Lucas S, Pacheco B, Erdei E, Ramone S, Nez T, Gonzales M, Campen MJ. Wohnnähe zu verlassenen Uranminen und Serumentzündungspotential in chronisch exponierten Navajo-Gemeinden. J Exposition Sci Environ Epidemiol.27: 365-371, 2017. PMID: 28120833; PMC5781233
Aragon M, Topper L, Tyler CR, Sanchez BN, Zychowski KE, Young T, Herbert G, Hall P, Erdely A, Eye T, Zeidler-Erdely P, Ottens AK, Campen MJ. Serum-übertragene Bioaktivität, die durch die Exposition gegenüber mehrwandigen Kohlenstoffnanoröhren in der Lunge verursacht wird, induziert eine Neuroinflammation über eine Beeinträchtigung der Blut-Hirn-Schranke. Proc Natl Acad Sci USA, 114:E1968-E1976, 2017. PMID: 28223486; PMC5347541
Zychowski KE, Kodali V, Harmon M, Tyler CR, Sanchez B, Ordonez Suarez Y, Herbert G, Wheeler A, Avasarala S, Cerrato JM, Kunda NK, Muttil P, Shuey C, Brearley A, Ali AM, Lin Y, Shoeb M, Erdely A, Campen MJ. Einatembarer Uranyl-Vanadat-haltiger Feinstaub, der aus einer alten Uran-Mine stammt, weist eine erhöhte kardiopulmonale Toxizität auf. Toxicol Sci. 164: 101–114, 2018. PMID: 29660078; PMCID: PMC6016706.
Tyler CR, Noor S, Young TL, Rivero V, Sanchez B, Lucas S, Caldwell KK, Milligan ED, Campen MJ. Altern verschlimmert durch akute Ozonexposition induzierte neuroinflammatorische Folgen. Toxicol Sci.163: 123-139, 2018. PMID: 29385576; PMC5920500
Mostovenko E, Young T, Muldoon PP, Bishop L, Canal CG, Vucetic A, Zeidler-Erdely PC, Erdely A, Campen MJ, Ottens AK. Das durch Nanopartikel-Exposition bedingte zirkulierende bioaktive Peptidom verursacht systemische Entzündungen und vaskuläre Dysfunktionen. Teil Fiber Toxicol. 16:20, 2019. PMID: 31142334; PMC in Bearbeitung.
Matthew Campen, PhD
Professor, Studienleiter,
UNM Hochschule für Pharmazie
Physical Address
Pflege-/Apothekengebäude
2502 Marble Avenue NE
Suite B-3
Albuquerque, NM 87131-0001
Postanschrift
Institut für Pharmazeutische Wissenschaften
MSC09
1 Universität von New Mexico
Albuquerque, NM 87131-0001