
Das McKenzie-Labor untersucht, wie Erinnerungen gebildet werden, wie sich Muster neuronaler Aktivität bilden und ausbreiten und wie die Ausbreitung von Anfällen kontrolliert werden kann.
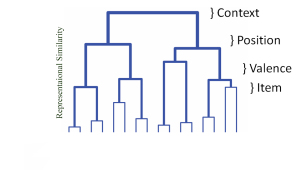
Obwohl es sich um eine der am besten untersuchten Hirnregionen handelt, bleibt die Kernfunktion des Hippocampus unbekannt. Meine Arbeit wurde geleitet von der relationales Gedächtnis-Framework der Hippocampusfunktion. Nach dieser Theorie können zeitlich und räumlich getrennte Ereignisse durch assoziative Verknüpfung in Hippocampus-Schaltungen miteinander in Beziehung gesetzt werden. Diese raumzeitliche Brücke ermöglicht die Entdeckung neuer Regeln und Kategorien, die ich als die Hauptfunktion dieses Gedächtnissystems sehe.
Irgendwie ist der Hippocampus in der Lage, kortikale Regionen zusammenzubinden, die sonst eine schwache Assoziativität hätten. Im Sprachgebrauch des maschinellen Lernens erweitert diese vom Hippocampus abhängige Kohärenz den Merkmalsraum, über den das Lernen stattfinden kann. Mich interessiert, wie Gesetzmäßigkeiten aus Einzelheiten extrahiert werden. Insbesondere untersucht mein Labor, wie das Kategorienlernen durch den erweiterten Merkmalsraum beeinflusst wird, der durch Hippocampus/kortikale Interaktionen geboten wird.

Im Laufe seines Lebens wird bei einem von 1 Amerikanern Epilepsie diagnostiziert. Die verfügbaren pharmakologischen Behandlungen haben erhebliche Nebenwirkungen und sind bei 26% der Bevölkerung nicht wirksam, die oft Jahre leiden, bevor sie nach alternativen Behandlungen suchen, wie z. B. einer chirurgischen Resektion des Anfallsherdes. In Fällen, in denen der Fokus unbekannt ist, mehrere Herde vorhanden sind oder eine Resektion zu riskant ist, kann eine tiefe Hirnstimulation eine Option sein. Derzeit gibt es zwei von der FDA zugelassene Optionen: chronische Stimulation des vorderen Thalamuskerns und Closed-Loop, „reagierende“ Stimulation auf die Zone des Anfallsbeginns. Niemand weiß, warum diese Stimulationsprotokolle effektiv sind, welche Patienten am meisten davon profitieren oder welche Strategie am besten zu bestimmen ist, wann und wie sie stimuliert werden sollen.
Mein Labor arbeitet an der Entwicklung von Algorithmen zur Vorhersage von Anfällen, um Anfälle zu erkennen, bevor sie beginnen. Diese Vorwarnung wird verwendet, um die neuronale Aktivität zu stören, um das Gehirn zu desynchronisieren und hoffentlich die Ausbreitung der iktalen Aktivität von der Anfangszone auf ansonsten gesunde Gehirnregionen zu stoppen.
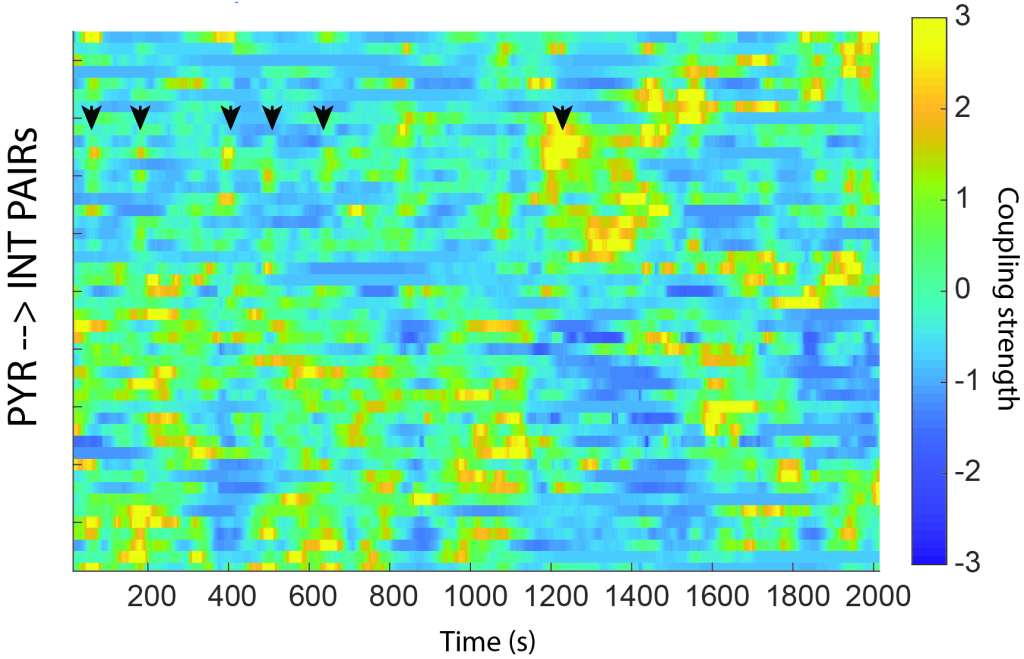
Niemand weiß, welche Eigenschaft der neuronalen Aktivität das Gehirn verwendet, um mit sich selbst zu kommunizieren. Es könnte die Identität dessen sein, welches Neuron feuert, die Rate, mit der diese Neuronen über ein bestimmtes Zeitfenster feuern, das Muster der synchronen Aktivität innerhalb eines Zeitfensters oder sogar die Reihenfolge, in der Neuronen relativ zueinander feuern. Ich denke, das Muster der synchronen Aktivität ist wichtig und das Lernen wird durch Veränderungen unterstützt, bei denen Neuronen unter bestimmten Umständen zusammen feuern. Mein Labor untersucht, wie erregende Neuronen miteinander konkurrieren, um in kurzen Zeitfenstern gemeinsam aktiv zu sein. Ich möchte wissen, ob die Plastizität der lateralen Hemmung vorschreibt, wer mit wem feuern darf und unter welchen Umständen diese Regeln der Koexistenz gelten.
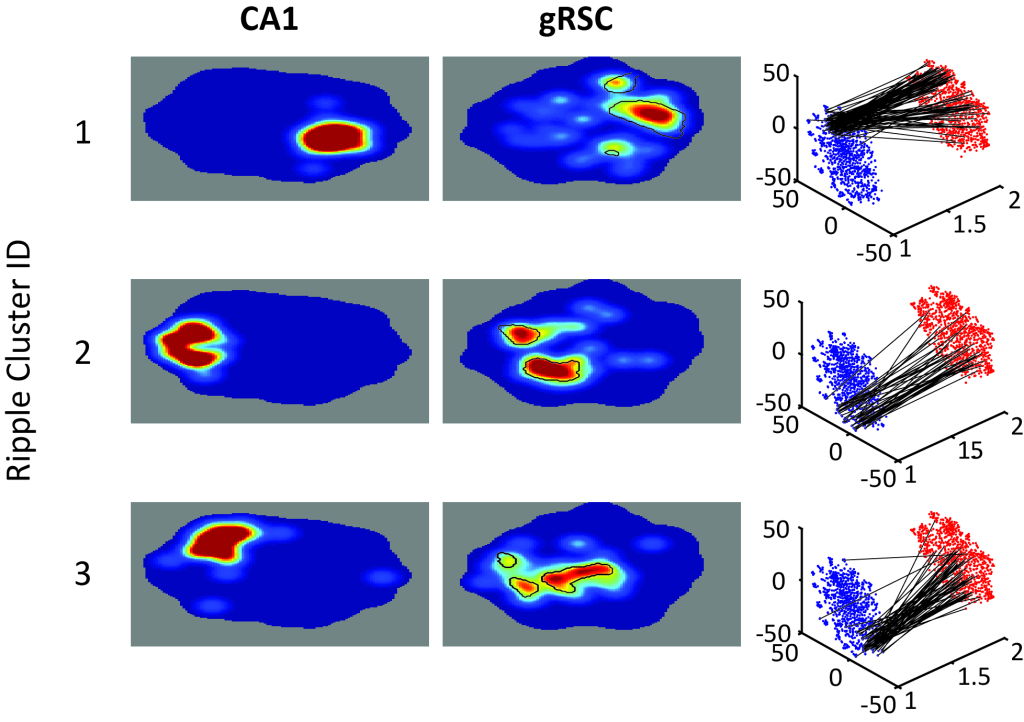
Komplexe Korrelationsmuster und eine fein ausbalancierte Synchronität sind nur dann von Bedeutung, wenn diese Spitzen unterschiedliche Aktivitäten in efferenten Gehirnregionen antreiben können. Wie werden Muster synchroner Aktivität ausgelesen? Wie interagieren eingehende Signale mit fortlaufenden Aktivitäten, die durch intraregionale, wiederkehrende Konnektivität entstanden sind? Können wir den einzigartigen Beitrag von Eingaben aus einer Gehirnregion zur Aktivität in einer anderen auseinandernehmen, um eine synaptische Übertragungsregel an jeder Synapse in diesen zentralen Speicherschaltkreisen herauszufinden?