Das Brigman-Labor untersucht, wie neurologische Entwicklungsstörungen und neuropsychiatrische Erkrankungen zu maladaptiven Verhaltensänderungen führen, die die Lebensqualität beeinträchtigen, mit dem Ziel, diese Defizite zu beheben und die Ergebnisse zu verbessern.

Traditionell nutzen Studien an Nagetieren Verhaltensweisen, die sich auf ihre Stärken konzentrieren (Graben, Riechen, Navigieren). Obwohl diese Ansätze eine Fülle von Daten erbracht haben, unterscheiden sie sich stark von der Art und Weise, wie wir kognitive Funktionen beim Menschen messen. Ein Hauptziel des Labors ist die Entwicklung und Validierung neuer Tests zur Untersuchung von Verhaltensergebnissen, die direkter mit klinischen Daten verglichen werden können. Seit 2001 arbeite ich an der Entwicklung und Verfeinerung von Aufgaben, bei denen ich Touchscreen-Ansätze für Bildschirmlernen, Gedächtnis und Kontrollverhalten von Führungskräften verwende. Diese Arbeit trug dazu bei, den Nutzen der Maus in der Erforschung exekutiver Funktionen zu etablieren, und führte zu einer breiteren Einführung von Touchscreen-Operantenparadigmen für das Hochdurchsatz-Screening. In den letzten 10 Jahren hat mein Labor die In-vivo-Aufzeichnung der Aktivität kortikaler Neuronen und lokaler Feldpotentiale während dieser Aufgaben integriert in vivo um uns zu helfen, besser zu verstehen, wie verschiedene Gehirnregionen bestimmte Verhaltensweisen vermitteln. In jüngerer Zeit waren wir an einer multiuniversitären Studie beteiligt, um die neuronale Aktivität im Zusammenhang mit spezifischem Verhalten sowohl bei Nagetieren als auch beim Menschen zu vergleichen und den Nutzen von Verhaltensdaten von Nagetieren bei der Entwicklung therapeutischer Ziele zu testen.
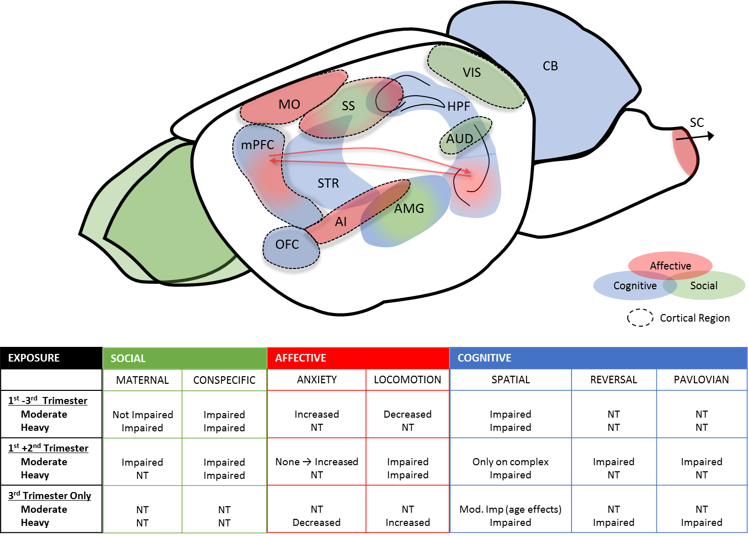
Der Einfluss von Alkohol auf die kortikale Funktion und die ihm zugrunde liegenden exekutiven Kontrollprozesse ist ein kritisches Thema, da der Verlust dieser Schlüsselprozesse zu einer erheblichen Verschlechterung der Lebensqualität führen kann. Obwohl die Auswirkungen der Exposition in der Entwicklung oder im Erwachsenenalter auf räumliche und in geringerem Maße auf operative Aufgaben gut dokumentiert sind, haben nur wenige Studien Online-Messungen der neuronalen Funktion genutzt, um Veränderungen auf Schaltkreisebene nach der Exposition zu analysieren. Techniken nutzen in vivo Aufzeichnungstechniken, Das Brigman-Labor, selbst eine moderatere pränatale Exposition reicht aus, um die Verhaltensflexibilität zu beeinträchtigen und kortikales Feuern und Rekrutieren zu verändern. Darüber hinaus fehlregulierte PAE die kortiko-striatale Koordination, die für die Verhaltensflexibilität erforderlich ist. Kürzlich haben wir gezeigt, dass PAE auch das Wiedereinstellungsverhalten und die visuell-räumliche Diskriminierung bei ansonsten EtOH-Abstinenten bis ins frühe Erwachsenenalter verändert. Spannenderweise haben wir auch gezeigt, dass die frühe Lebensumgebung die Ergebnisse dieser Modelle erheblich verändern kann.
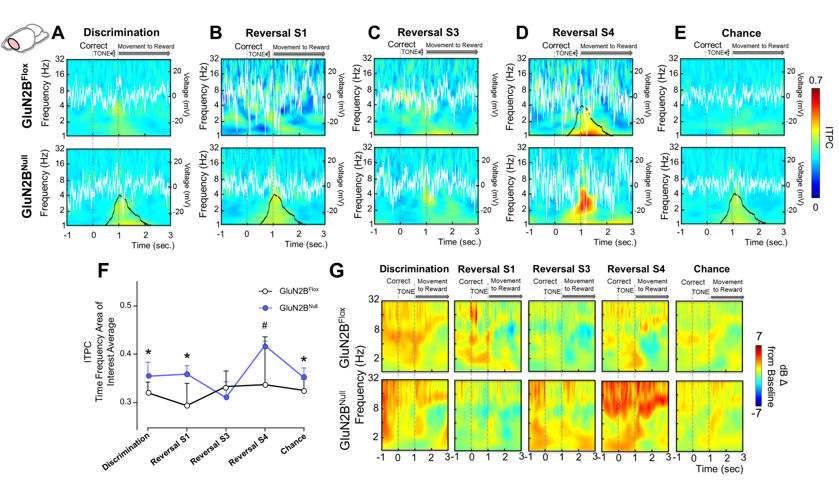
Der Verlust spezifischer NMDAR-Subtypen im Kortex, Hippocampus und Striatum kann sowohl das Lernen als auch die synaptische Plastizität verändern. Basierend auf grundlegenden Studien, die im Holmes-Labor durchgeführt wurden, hat mein Labor die Rolle von GluN2A und GluN2B, die NMDAR enthalten, mithilfe von vorderhirnweiten und bedingten Knock-out-Modellen und pharmakologischer Inaktivierung untersucht. Wir haben gezeigt, dass der Verlust von GluN2A im gesamten Gehirn das einfache Lernen und die Flexibilität bei einer satzverändernden Aufgabe beeinträchtigt. Darüber hinaus haben wir gezeigt, dass der Verlust von GluN2B im Kortex und Hippocampus das Diskriminierungslernen verschont, aber die Fähigkeit beeinträchtigt, geeignete Regeln zu lernen und diese Regeln auf neue Probleme anzuwenden. Neuere Studien kombinierten GluN2B-Knockout-Mäuse mit in vivo Aufzeichnung während des Verhaltens, um zu zeigen, dass der Verlust der Untereinheit sowohl die kortikale als auch die stratale Aktivität und die Art und Weise, wie die Regionen kommunizieren, verändert. Angesichts der Erkenntnisse, dass entwicklungsbedingte Beeinträchtigungen wie pränatale Alkoholexposition die Expression der NMDAR-Untereinheit verändern, untersuchen wir derzeit, ob diese Expression effizientes Lernen und Wandel vermitteln kann.
Beeinträchtigungen der exekutiven Funktion sind ein gemeinsames Merkmal zahlreicher neuropsychiatrischer Erkrankungen. Tatsächlich können kognitive Defizite einen größeren negativen Einfluss auf die Lebensqualität von Patienten mit Schizophrenie haben als negative oder positive Symptome. Präklinische Modelle der Schizophrenie haben gezeigt, wie der Verlust bestimmter Systeme zu Verhaltensstörungen bei Übersetzungsaufgaben führte. Zuvor habe ich gezeigt, dass der Verlust der GABAergen Funktion im Vorderhirn ausreicht, um die Aufmerksamkeit zu verändern und das Umkehrlernen zu beeinträchtigen, während chronisches Phencyclidin die sozialen Untersuchungsmaßnahmen verändert, aber Lernen und Umkehrlernen verschont. Kürzlich hat das Brigman Lab in Zusammenarbeit mit dem Mellios Lab an der UNM gezeigt, dass dies der Fall ist CircHomer1a, eine mit Neuronen angereicherte circRNA, die im frontalen Kortex exprimiert wird, reichte aus, um die Umkehrung unserer visuellen Unterscheidungsaufgabe auf dem Touchscreen zu beeinträchtigen. Wichtig ist, dass das Mellios-Labor dies auch gezeigt hat CircHomer1a war in postmortalen Proben von PFC-Gewebe bei Patienten mit Schizophrenie und bipolarer Störung signifikant reduziert. Derzeit laufende Verbundstudien untersuchen die Mechanismen, wie Veränderungen in zirkulären microRNAs das Verhalten beeinträchtigen können.