Eine beispiellose Krise der öffentlichen Gesundheit des Missbrauchs verschreibungspflichtiger Opioide sowohl auf regionaler als auch auf nationaler Ebene erfasst derzeit die Vereinigten Staaten. Während die zugrunde liegenden Ursachen im Zusammenhang mit dieser Krise der öffentlichen Gesundheit weitgehend spekulativ sind, ist ein möglicher Faktor die dramatische Eskalation der verschreibungspflichtigen Opioidbehandlung für chronische Schmerzen in den letzten zehn Jahren. Präklinische Studien belegen überzeugend, dass Opioide nicht nur negative Folgen für Schmerzen haben, sondern auch, dass chronische Schmerzen durch nicht-opioide Medikamente gezielt werden können, denen eine direkte Wirkung auf Neuronen fehlt, wodurch die Suchtgefahr verringert wird. Der Transport von Immunzellen zum Zentralnervensystem (ZNS) und immunähnlichen Gliazellen innerhalb des ZNS (zB Astrozyten und Mikroglia) ist für die Entwicklung und Aufrechterhaltung von akuten bis chronischen Schmerzproblemen durch unangemessene neuroimmune Aktivierung notwendig. Ein im ZNS gefundener Immunrezeptor ist der Toll-like-Rezeptor 4 (TLR4), von dem bekannt ist, dass er die Freisetzung von proinflammatorischen Zytokinen wie Interleukin-1b (IL-1b) induziert. Nicht-Opioid-Verbindungen, die den TLR4-IL-1b-Weg blockieren, können einen wesentlich besseren therapeutischen Nutzen bieten als Opiate. Einer Kundenziele meines Labors besteht darin, Nicht-Opioid-Medikamente zu identifizieren, die sich endogene entzündungshemmende Mechanismen zunutze machen, die zur Unterdrückung proinflammatorischer Zytokine wie IL-1b führen. Neben dem Testen mehrerer neuartiger und von der FDA zugelassener Verbindungen arbeitet mein Labor eng mit dem UNM Center for Molecular Drug Discovery zusammen http://unmcmd.health.unm.edu um potenziell neuartige Schmerztherapeutika zu identifizieren und zu testen, die opioidbedingte Nebenwirkungen vermeiden.
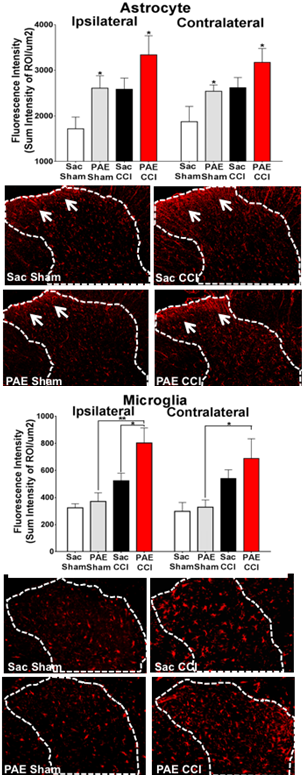
Alkoholexposition während der Schwangerschaft kann zu einer Konstellation von leichten bis schweren Behinderungen führen, die kognitive und Verhaltensdefizite einschließen, die ein Kontinuum darstellen, das als fetale Alkoholspektrumsstörungen (FASD) mit einer Prävalenz von ~4.8 % in einigen US-Regionen bezeichnet wird. Eine wachsende Zahl von Beweisen deutet stark auf die negativen Auswirkungen der Alkoholexposition während der Entwicklung des zentralen Nervensystems (ZNS) auf die zelluläre und molekulare Programmierung der neuroimmunologischen Funktion hin. In Tiermodellen zur pränatalen Alkoholexposition (PAE) ist die Expression der Immunsignalmoleküle des Gehirns, der proinflammatorischen Zytokine Interleukin-1 (IL-1β), Tumornekrosefaktor-alpha (TNF-) und des Chemokins CCL2 signifikant erhöht . Während bei Kindern mit FASD der Nachweis von sensorischen Anomalien einschließlich der taktilen Sensibilität als Folge psychosozialer Faktoren angesehen wird, kann die zugrunde liegende Ursache eine neurologische Dysfunktion sein. Tatsächlich zeigen Tiermodelle von PAE eine erhöhte Empfindlichkeit gegenüber Lichtberührung, einem wohlbekannten pathologischen sensorischen Zustand, der durch aberrante neuronale Aktionen im Rückenmark vermittelt wird. Klinisch ist Berührungsüberempfindlichkeit bei chronischen Schmerzpatienten als Allodynie bekannt, und Tiermodelle der Allodynie zeigen, dass eine pathologische Aktivierung von Schmerzneuronen im Rückenmark auftritt, die durch IL-1β, TNF- und CCL2 vermittelt wird. Gliazellen (Astrozyten und Mikroglia) sind die Hauptproduzenten dieser proinflammatorischen Zytokine. Somit zeigen Tiermodelle von Allodynie und PAE eine überraschende neuroimmune Überlappung. Das Ziel dieser Forschung ist es, andere Spinalzelltypen als Neuronen zu identifizieren, die eine wichtige Rolle bei der neuroimmunen Anpassung bei PAE-Nachkommen spielen, die die Anfälligkeit von Erwachsenen für Neuropathie erhöhen. Die Ergebnisse werden neue Erkenntnisse für das Verständnis der entwicklungsbedingten Ursprünge von aberranten PNS- und ZNS-Immuninteraktionen aufgrund von PAE liefern und die Anfälligkeit für im Erwachsenenalter beginnende Krankheiten wie neuropathische Schmerzen aufdecken.
Mein Labor arbeitet eng mit dem New Mexico Alcohol Research Center (NMARC; Alkoholforschungszentrum in New Mexico ), um die neurobiologischen Mechanismen zu verstehen, die einer FASD-assoziierten ZNS-Erkrankung zugrunde liegen, und dieses Wissen zu nutzen, um wirksamere Interventionen für Patienten mit FASD zu entwickeln.
3. Mechanismen der Glukokortikoidresistenz bei pränataler Alkoholexposition
Viele der physiologischen Prozesse, die durch die pränatale Alkoholexposition (PAE) beeinflusst werden, werden durch Glukokortikoide reguliert. Glucocorticoid-Resistenz (dh verringerte Empfindlichkeit gegenüber den Wirkungen von GCs) und Glucocorticoid-Rezeptor-Unempfindlichkeit werden mit einer Vielzahl von chronischen Erkrankungen in Verbindung gebracht, von denen viele sowohl mit der Immunfunktion als auch mit PAE in Zusammenhang stehen. Der Forschungsschwerpunkt liegt darauf, zu untersuchen, ob PAE eine Glukokortikoidrezeptor-Unempfindlichkeit erzeugt, die sich in einer Fehlregulation der Hypothalamus-Hypophysen-Achse und einer Zunahme der proinflammatorischen und einer Abnahme der entzündungshemmenden Zytokine im Gehirn unter Stressbedingungen äußert, und ob eine Entwicklungsverschiebung des normalen Stress- und Immunsystems Reaktionen während des frühen Lebens beobachtbar sind und ob diese Veränderungen bis ins Erwachsenenalter andauern. Das Ziel der Forschung meines Labors ist es, molekulare Mechanismen zu identifizieren, die Veränderungen in der Programmierung der Glukokortikoid-Sensitivität während der ZNS-Entwicklung zugrunde liegen und die bis ins Erwachsenenalter andauern. Diese Informationen werden verwendet, um gezielte Interventionen zu entwickeln, die die Auswirkungen von PAE auf die Glukokortikoidrezeptor-Empfindlichkeit und die Reaktionen von neuroimmunen Signalmolekülen umkehren oder reduzieren. Um diese Ziele zu erreichen, arbeitet mein Labor mit dem New Mexico Alcohol Research Center (NMARC; Alkoholforschungszentrum in New Mexico).