Bradfute-Labor

Infektionskrankheiten/Erreger als solche, die neu in einer Population aufgetreten sind oder existiert haben, aber in Häufigkeit oder geografischer Reichweite schnell zunehmen

Die Hirschmaus Peromyscus maniculatus trägt das Hantavirus Sin Nombre, das für die meisten Fälle des kardiopulmonalen Hantavirus-Syndroms in den USA verantwortlich ist.
Bildnachweis: Sam Goodfellow

Ebola-Virus in infizierter Milz. Pfeile zeigen auf einzelne Virionen. Bildgebung unter Verwendung von Transmissionselektronenmikroskopie.
Bildnachweis: Steven Bradfute, PhD

Zika-Virus-Plaque-Assay zur Identifizierung neutralisierender Antikörper
Bildnachweis: Steven Bradfute, PhD
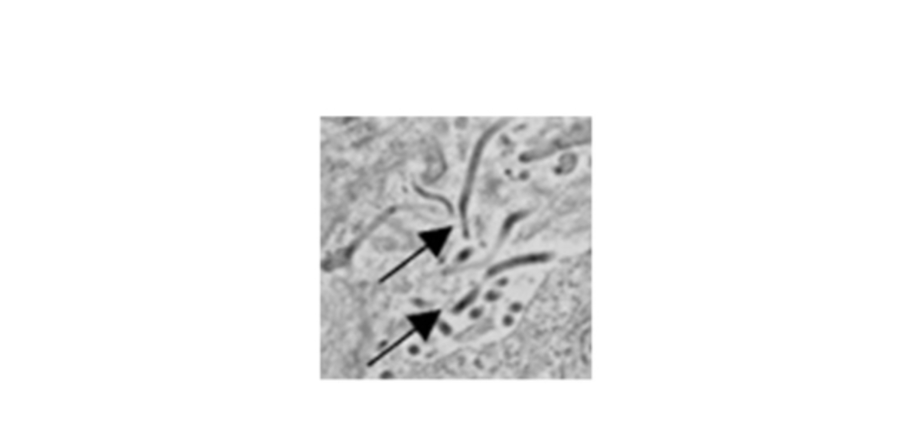
Eine Infektion mit dem Ebola-Virus führt zum Absterben von Immunzellen. Die Fluoreszenzmikroskopie zeigt Milzzellen eines infizierten Tieres. Rot markiert sterbende Zellen und zeigt alle Zellen an.
Bildnachweis: Steven Bradfute, PhD
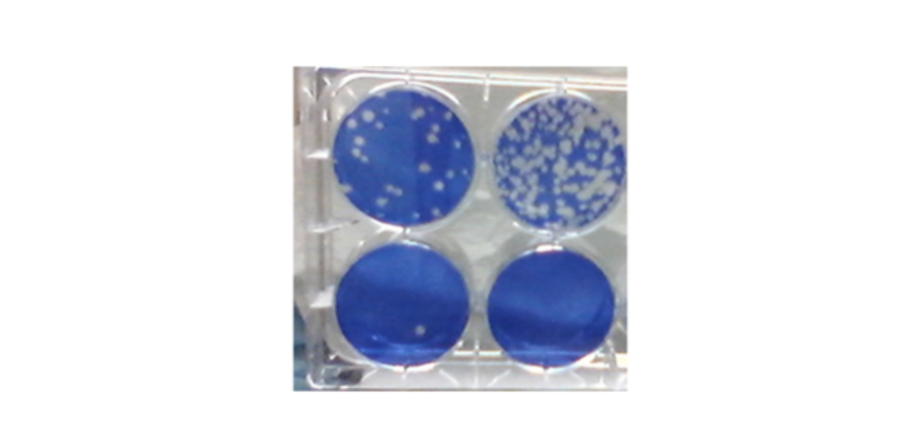
SARS-CoV-2-Plaque-Assay zur Messung der Hemmung der Coronavirus-Replikation. Blaue Farbe ist lebende Zellen; Weiße Löcher sind "Plaketten, die zeigen, wo SARS-CoV-2 Zellen infiziert und abgetötet hat.
Bildnachweis: Steven Bradfute, PhD
Hantaviren sind gefährliche Krankheitserreger, die beim Menschen schwere Erkrankungen verursachen. Die Viren vermehren sich harmlos in Nagetieren und werden durch Inhalation von Viren in aerosolisierten Nagetierausscheidungen auf den Menschen übertragen. Das erste pathogene Hantavirus in den USA, das Sin Nombre Hantavirus, wurde 1993 in New Mexico entdeckt. New Mexico hatte die meisten Fälle von Sin Nombre Hantavirus als jeder andere Bundesstaat, was es zu einem wichtigen Virus für unsere Region macht, insbesondere angesichts seiner hohen Letalität Rate beim Menschen (~35%). Unsere Forschung deckt mehrere Bereiche der Hantavirus-Biologie und -Therapie ab.
-Neutralisierende Antikörper für Therapeutika.
Wir arbeiten im Rahmen eines NIH U19-Stipendiums des Albert Einstein College of Medicine zusammen, um monoklonale Antikörper gegen mehrere Hantaviren zu identifizieren und zu analysieren. Diese Daten werden vom Konsortium verwendet, um Antikörper auszuwählen, um ihre Fähigkeit zu testen, kleine Tiermodelle vor einer Infektion zu retten. Diese Verbundstudie wird im Podcast „This Week in Virology“ hervorgehoben: https://www.microbe.tv/twiv/twiv-578/
--Langzeitgedächtnis-Immunreaktionen bei Überlebenden des Sin Nombre-Hantavirus.
Wir verfolgen langfristige Immunantworten bei Überlebenden des Hantavirus Sin Nombre. Bis heute haben wir sehr starke Antikörperreaktionen bei Überlebenden gefunden, wobei Patienten bereits 23 nach der Infektion noch nachweisbare neutralisierende Antikörperreaktionen zeigen. Diese Daten deuten darauf hin, dass Hantavirus-Überlebende eine starke, lang anhaltende Immunität gegen eine erneute Infektion erzeugen. Wir haben auch einen 13-Farben-Durchflusszytometrie-Assay etabliert, um spezifische Hantavirus-Recall-Reaktionen in multiplen CD8+- und CD4+-T-Zell-Kompartimenten zu testen.
--Genetische Analyse des Sin Nombre Virus bei wild gefangenen Nagetieren in New Mexico.
Das Wirtsnagetier für das Hantavirus Sin Nombre ist die Hirschmaus Peromyscus maniculatus. Hirschmäuse haben ein sehr umfangreiches natürliches Verbreitungsgebiet, wie sie in fast allen USA (mit Ausnahme der Regionen im Südosten) vorkommen. Die Infektion mit dem Sin Nombre-Virus beim Menschen konzentriert sich jedoch hauptsächlich auf den Westen und Südwesten der USA. Wir stellen die Frage „Warum sind die Hirschmäuse überall, aber infizierte Menschen nicht?“ Wir beantworten diese Frage, indem wir wilde Hirschmäuse in ganz New Mexico sowohl in endemischen als auch in nicht endemischen Regionen des Menschen fangen, um festzustellen, ob a) das Sin Nombre-Virus nur in endemischen Regionen des Menschen gefunden wird oder b) die Virusgenomsequenz ist in den verschiedenen Regionen deutlich unterschiedlich.

Das Bradfute-Labor nutzte unsere Expertise bei neu auftretenden viralen Krankheitserregern, um das Zika-Virus während des Ausbruchs 2013-2016 zu untersuchen. Wir haben mit den Los Alamos National Laboratories zusammengearbeitet, um die Wirksamkeit eines neuartigen DNA/Nanopartikel-Liefersystems zum Schutz von Mäusen vor Zika-Virusinfektionen zu testen. Wir fanden heraus, dass ein Plasmid-DNA-Impfstoff, der in einem neuartigen Verabreichungssystem formuliert wurde, dosisabhängig eine schützende Immunität gegen eine Zika-Virusinfektion bei Mäusen induzierte.
Hraber P, Bradfute SB, Clarke E, Ye C und Pitard B. Amphiphile Blockcopolymerabgabe eines DNA-Impfstoffs gegen das Zika-Virus. Impfstoff 36:6911 (2018)

Das Bradfute-Labor ist an der Erprobung neuartiger Impfstoffe zur Induktion kreuzreaktiver Immunantworten gegen multiple Enzephalitis-Viren beteiligt, die von Mücken übertragen werden und sowohl bei Pferden als auch bei Menschen schwere Krankheiten verursachen.
-- Nanocarrier-Antigenabgabe für breit schützende Alphavirus-Einzeldosis-Impfstoffe.
Wir arbeiten mit den Los Alamos National Laboratories (LANL) zusammen, um einen neuartigen DNA-basierten Impfstoff zu testen, der eine einmalige, lang anhaltende Immunität gegen mehrere Alphaviren bietet. Unsere Rolle in dieser Zusammenarbeit besteht darin, DNA-Impfstoffe auf ihre Induktion von Antikörper- und T-Zell-Antworten in Mäusen zu testen, wobei BSL-3-Alphaviren als Ziele verwendet werden.
-- Lange nicht-kodierende RNAs bei einer Infektion mit dem Virus der venezolanischen Pferdeenzephalitis.
Wir haben erst kürzlich einen Zuschuss für ein großes Projekt erhalten, das die Rolle von langen nicht-kodierenden RNAs bei der zellulären Reaktion auf eine Infektion mit dem venezolanischen Pferdeenzephalitis-Virus untersucht. Dieses Projekt wird unsere BSL-3-Einrichtungen für ausgewählte Agenten am UNM HSC nutzen, um zu testen, welche langen nicht-kodierenden RNAs nach einer In-vitro- und In-vivo-Infektion eines pathogenen venezolanischen Pferdeenzephalitis-Virus im Vergleich zu einer nicht-pathogenen Version desselben Virus exprimiert werden. Auf diese Weise werden wir in der Lage sein, direkt zu vergleichen, welche langen nicht-kodierenden RNAs bei einer erfolgreichen zellulären Antwort mit einer erfolglosen Antwort induziert oder unterdrückt werden.
Das Ebola-Virus ist ein tödlicher Krankheitserreger mit einer Sterblichkeitsrate von über 40%. Obwohl sich das Virus traditionell auf kleine Ausbrüche in abgelegenen Dörfern beschränkte, breitete sich das Virus zum ersten Mal in großen Städten aus und verursachte von 2013 bis 2016 einen weltweiten Ausbruch. Wir sind an den Bemühungen zur Entwicklung von Impfstoffen und Therapeutika gegen dieses Virus beteiligt.
- Entwicklung von Impfstoffen und Therapeutika gegen das Ebola-Virus.
Wir fanden heraus, dass Veränderungen der Glykosylierung (Zuckermuster) im viralen Glykoprotein dramatisch beeinflussen, wie diese Proteine eine Immunantwort auslösen, wenn sie als Impfstoff verwendet werden. Diese Veränderungen der Glykosylierung treten auf, wenn die Impfstoffe in verschiedenen Zelltypen hergestellt werden. Unsere Ergebnisse waren relevant, da unterschiedliche Zelltypen für verschiedene Impfstoffe verwendet werden.
- Gleichzeitige Verabreichung von Therapeutika und Impfstoffen gegen das Ebola-Virus.
Unsere Ebola-Virus-Studien wurden mit der kürzlichen Finanzierung eines zweiten Stipendiums fortgesetzt, in dem wir untersuchen, wie sich die Verabreichung von Kurzzeittherapeutika neben Langzeitimpfstoffen auf die Wirksamkeit dieser Behandlungen auswirkt. Ziel ist es, den optimalen Zeitpunkt für die Verabreichung beider therapeutischer Medikamente für einen sofortigen Schutz gegen das Virus zu bestimmen, ohne den Langzeitschutz von gleichzeitig verabreichten Impfstoffen aufzuheben

Angesichts der Dringlichkeit der anhaltenden Coronavirus-Pandemie leitete das Bradfute-Labor die Arbeit des BSL-3 SARS-CoV-2-Virus am UNM HSC. Wir haben mit über 25 verschiedenen akademischen und kommerziellen Gruppen zusammengearbeitet, um unsere einzigartige Spezialisierung zur Erforschung von Therapeutika, Impfstoffen, Inaktivierung, Grundlagenbiologie und Patientenprobenanalyse für SARS-CoV-2 zu nutzen.
-- Bewertung neutralisierender Antikörper bei rekonvaleszenten und akuten COVID-19-Patienten.
Das Bradfute-Labor testete neutralisierende Antikörpertiter im Plasma von rekonvaleszenten Personen und Plasma von akuten COVID-19-Patienten, denen das rekonvaleszente Plasma als experimentelle Therapie an der UNMH infundiert worden war. Wir stellten fest, dass, obwohl alle getesteten rekonvaleszenten Patienten positive Antikörpertiter gegen das Spike-Oberflächenprotein aufwiesen, wenn sie durch Enzyme-linked Immunosorbent Assays (ELISA) gemessen wurden, die neutralisierenden Antikörper gegen lebendes SARS-CoV-2 bei rekonvaleszenten Personen jedoch sehr niedrig waren und daher weder die Antikörperspiegel erhöhen noch das Fortschreiten der Krankheit bei den Empfängern verbessern. Diese Studie unterstrich die Bedeutung des Pre-Screenings von Rekonvaleszenzplasma nicht nur auf Gesamtantikörper mittels ELISA, sondern auch auf die Neutralisierung der Antikörpertiter vor der Infusion bei Patienten. Wir haben auch mit TriCore Reference Laboratories zusammengearbeitet, um zu zeigen, dass neutralisierende Antikörpertiter mit einem kommerziell eingesetzten einfachen und schnellen Antikörpernachweis-Assay korrelieren, der keine Verwendung von Lebendviren erfordert.
-- Methoden zur Inaktivierung von SARS-CoV-2 auf Oberflächen.
Wir haben mehrere chemische, Hitze-, Licht- und andere Methoden getestet, um lebendes SARS-CoV-2 zu inaktivieren. Wir haben auch gezeigt, dass eine häufig vorgeschlagene Methode zur Dekontamination von N95-Masken mit trockener Hitze bei der Eliminierung von lebendem SARS-CoV-2 nicht wirksam ist.
-- Analyse von longitudinalen Antikörper- und T-Zell-Reaktionen bei rekonvaleszenten COVID-19-Individuen. Wir wurden kürzlich von UNM HSC CTSC finanziert, um Immunreaktionen bei Patienten nach ihrer Genesung von einer SARS-CoV-2-Infektion zu verfolgen. Wir haben ein für diese Arbeit zugelassenes IRB und rekrutieren derzeit 50 Patienten, um ihre Antikörper- und T-Zell-Antworten bis zu 10 Jahre lang zu analysieren. Diese Arbeit wird wichtige Fragen beantworten, wie lange COVID-19-Überlebende Immunantworten gegen das Virus haben.
-- In-vitro-Screening von kleinen Molekülen gegen SARS-CoV-2.
Einer der Hauptaspekte meiner SARS-CoV-2-Arbeit ist das Testen kleiner Moleküle auf ihre in-vitro-Wirksamkeit gegen lebende Viren im BSL-3-Labor. Wir haben mit UNM HSC, dem UNM-Hauptcampus und Nicht-UNM-Institutionen zusammengearbeitet, um ihre Medikamente auf antivirale Aktivität zu testen. Mein Labor hat viele kleine Moleküle gescreent und eine Handvoll gefunden, die die Replikation stark hemmen. Aus dieser Arbeit sind viele Stipendienanträge sowie Manuskripte in Vorbereitung oder eingereicht worden, von denen ein Beispiel unten aufgeführt ist.